VeriFi® Library Amplification Mix:困難なサンプル向けの堅牢な PCR ミックス
Pedro Quintas, PhD, Constantine Garagounis, PhD, & Matteo Beretta, PhD
Introduction
Challenging contexts for PCR
PCR 阻害は分子生物学者にとって深刻な課題となることがあります。ほとんどの場合、サンプル抽出と PCR セットアップ中に適切な手順を踏めば阻害を最小限に抑えたり、排除したりできますが、PCR 阻害物質が問題となる状況も数多くあります。これは、血液、組織、細胞破片など、特定のサンプル タイプに阻害化合物が多く含まれている場合や、サンプルの準備が最適に行われていない場合に発生することがあります。さらに、定義上 PCR 阻害化合物が含まれる可能性が高い粗サンプルで PCR を実施することへの関心が高まっています。臨床診断、法医学的検査、環境モニタリングでは、信頼性の高い結果を提供するために、このような阻害物質に耐えられる PCR 試薬が必要です。
したがって、阻害剤耐性ポリメラーゼを持つことは、この課題を克服する上で有益です。このような困難な PCR での使用に最適なポリメラーゼを特定するために、血液サンプルおよび DNA 抽出溶液に含まれる複数の一般的な PCR 阻害剤の存在下で、当社の最新の校正ミックスである VeriFi® Library Amplification Mix に対して、多数の市販の校正ポリメラーゼ (VeriFi® Hot Start Mix、NEBNext Ultra II Q5 Master Mix、および Quantabio repliQa Hifi ToughMix) をテストしました。
Blood inhibitor tolerance – a critical advantage
血液または血液由来サンプルの DNA PCR 検査は、多くの診断検査や研究現場で使用されています。しかし、粗血液に含まれる多くの成分は PCR の阻害物質であり、抽出が完璧に行われないと、血液サンプルから抽出された DNA が簡単に汚染される可能性があります。血液に含まれる主な PCR 阻害物質には、ヘマチン、ヘパリン、ヘモグロビンがあります。これら 3 つの化合物はいずれも、さまざまな方法で PCR を阻害します。ヘモグロビンの副産物であるヘマチンは DNA ポリメラーゼの活性に影響を与え、PCR 効率の低下や反応の完全な失敗を引き起こす可能性があります。ヘモグロビンは、それほど強力な阻害物質ではありませんが、DNA に結合して DNA ポリメラーゼの熱安定性に影響を与えるため、全体的な増幅収量が低下します。ヘパリンは血液サンプルの抗凝固剤としてよく使用されますが、DNA ポリメラーゼ活性とプライマーの DNA ターゲットへの結合の両方を妨害し、それによって PCR 反応を妨げる可能性があります。したがって、これらの阻害剤に耐性がある、または少なくとも耐性のあるポリメラーゼを開発することは、臨床現場や血液サンプル検査に基づく研究において有用です。
Broad-spectrum inhibitor resistance
また、これらのポリメラーゼの SDS、フェノール、尿素に対する耐性もテストしました。これらはすべて、不適切に抽出された DNA サンプルや実験室の汚染物質として存在することがよくあります。洗剤の SDS は、ポリメラーゼを含むタンパク質を変性させる可能性があり、組織や細胞株から抽出された DNA の一般的な汚染物質です。DNA 抽出に使用されるフェノールは、PCR 反応に持ち込まれ、酵素の変性または DNA への挿入によって増幅を阻害します。カオトロピック剤である尿素は、ポリメラーゼなどのタンパク質を展開することができ、尿由来のサンプル中に多く存在します。これらの阻害剤に対する耐性は、このような抽出汚染物質が蔓延している可能性のある、さまざまな生物学的サンプル、環境サンプル、臨床検体、複雑な混合物からの増幅に有利です。
複雑なサンプルからの増幅を成功させるには、校正ポリメラーゼの阻害剤耐性が不可欠です。VeriFi® Library Amplification Mix は、テストされたすべての阻害剤に対して高い耐性を示します。VeriFi® Library Amplification Mix はこれらの物質に対する耐性を備えているため、法医学サンプル、生検組織、血液スポット、および一般的な実験用化学物質で汚染されたサンプルからの増幅を確実に成功させることができます。
Method
PCR 増幅は、マウスゲノム DNA (10 ng / 20 μL 反応) をテンプレートとして、GAPDH 遺伝子の 2700 bp 領域 (Fwd: TGAAAGACAAGAAACAGGGGAGC; Rev: TGCTGTGTCACTACCGAAGAAC) のプライマーを使用して実行されました。各プライマーの濃度は、各メーカーの説明書に従って、VeriFi® Hot Start Mix および VeriFi® Library Amplification Mix では 400 nM、NEBNext Ultra II Q5 Master Mix では 500 nM、repliQa HiFi ToughMix では 300 nM でした。表 1 に従って、さまざまな濃度の阻害剤を反応混合物に添加しました。
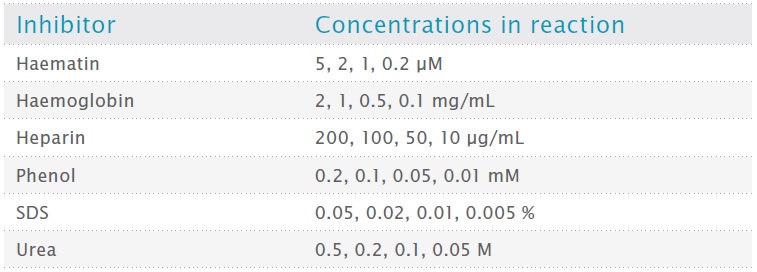
表1:テストされた阻害剤の濃度
サイクリング条件はそれぞれのマニュアルに従っており、各ポリメラーゼは推奨条件下でテストされました。PCR 後、アンプリコンは D5000 テープを使用して Agilent TapeStation で定量化されました。
Results
Challenging proofreading polymerases with common blood sample inhibitors
血液および臨床サンプルの検査における各混合物の有用性を評価するために、3 つの一般的な血液サンプル阻害剤を使用して校正ポリメラーゼをテストしました (図 1)。
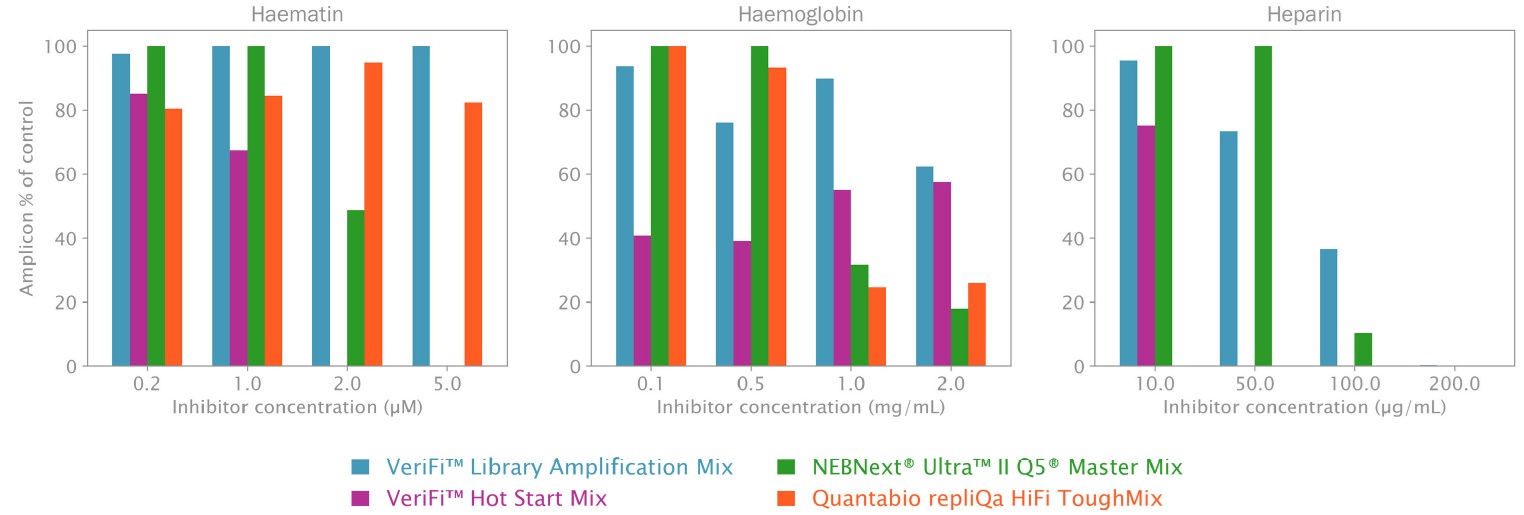
図1:血液サンプル中の一般的な PCR 阻害剤の存在下での校正ポリメラーゼ ミックスの増幅収率
PCR は、方法の説明に従って、上の図に示されている校正ポリメラーゼ PCR ミックスでセットアップされました。反応は、示されている血液由来の PCR 阻害剤の量を増やしながら実行されました (X 軸)。PCR 収量は、各ミックスと阻害剤濃度について、各ミックスの陽性コントロール (阻害されていない反応) のパーセンテージとして計算されました (Y 軸)。VeriFi® Library Amplification Mix は、最高の阻害剤濃度でも最高の収量を保持します。
Haematin:ヘマチン
0.2 μM では、すべてのミックスが同等に良好なパフォーマンスを発揮します。1 μM および 2 μM の濃度増加では、VeriFi® Library Amplification Mix のパフォーマンスは低下せず、テストしたミックスの中で最も効率的です。2 μM および 5 μM では、VeriFi® Library Amplification Mix の収量が最も高く、このミックスは他のすべてのミックスと比較して、ヘマチンの濃度が高い場合に優れたパフォーマンスを発揮することを示しています (図 1、左)。
Haemoglobin:ヘモグロビン
VeriFi® Library Amplification Mix は、低濃度 (0.1 および 0.5 mg/mL) では他のミックスと同等の耐性を示します。ただし、1 mg/mL および 2 mg/mL のヘモグロビンでは、VeriFi® Library Amplification Mix が増幅への影響が最も少なく、他のすべてのミックスよりも高いレベルを維持しています (図 1、中央)。
Heparin:ヘパリン
中程度のヘパリン濃度 (10 および 50 μg/mL) であっても、VeriFi® Library Amplification Mix は、これらの低い阻害剤濃度で最高のパフォーマンスを発揮する NEBNext Ultra II Q5 Master Mix (Green) と同等であり、ポリメラーゼ活性への干渉が最小限であることを示唆しています。100 μg/mL のヘパリンでは、VeriFi® Library Amplification Mix は他のすべてのミックスよりも優れた増幅率を達成し、ヘパリンに対する耐性が高いことを示しています (図 1、右)。
これらの結果から、VeriFi® Library Amplification Mix は、NEBNext Ultra II Q5 Master Mix、repliQa HiFi ToughMix、および VeriFi® Hot Start Mix と比較して、テストされた濃度での血液由来サンプル阻害物質であるヘマチン、ヘモグロビン、およびヘパリンに対する耐性が一般的に強いと自信を持って結論付けることができます。
Challenging proofreading polymerases with common extraction inhibitors
さらに、フェノール、SDS (ドデシル硫酸ナトリウム)、尿素という 3 つの一般的な実験用化学物質を使用して校正ポリメラーゼをテストしました。これら 3 つの化合物はすべて強力な PCR 阻害剤であり、DNA 抽出溶液によく使用されます。これらの阻害剤は、PCR ワークフローで不適切に抽出された DNA サンプルまたは汚染された DNA サンプルを使用する場合の各ミックスの信頼性を評価するために選択しました。
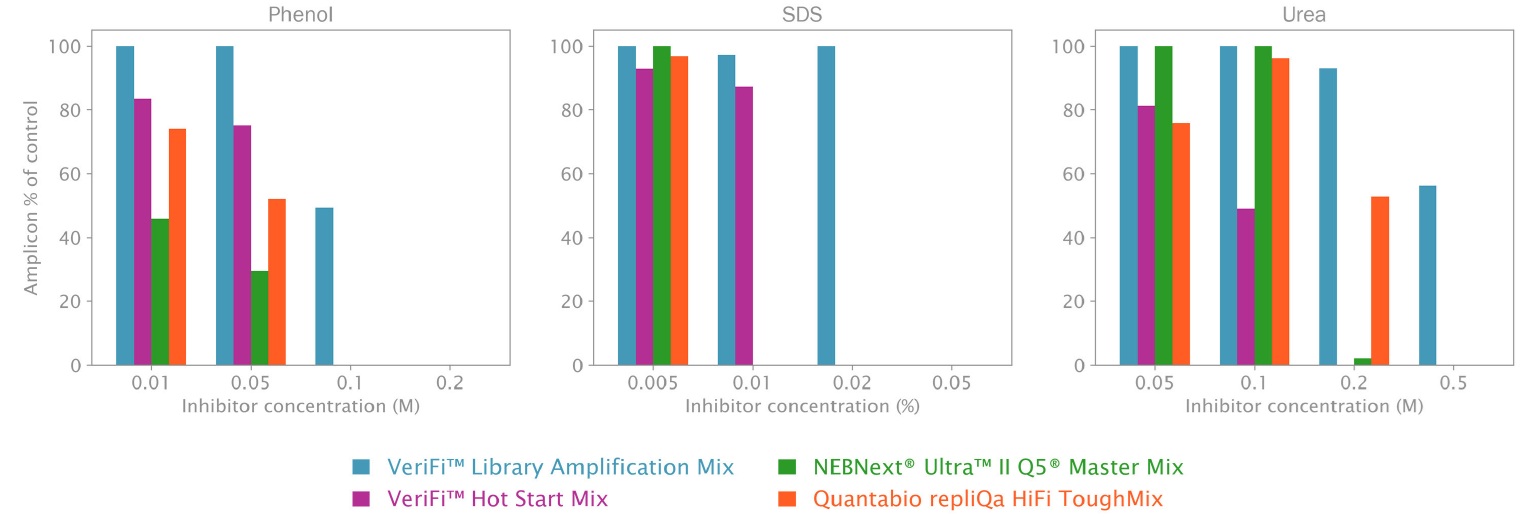
図2:一般的な実験室用化学的 PCR 阻害剤の存在下での校正ポリメラーゼ ミックスの増幅収率
「Methods」で説明したように、上図に示す校正 ポリメラーゼ PCR ミックスを使用して PCR をセットアップしました。反応は、示されている一般的な化学 PCR 阻害剤の量を増やしながら実行されました (X 軸)。PCR収量は、各ミックスおよび各ミックスのポジティブコントロール(非阻害反応)のパーセンテージとして阻害剤濃度について計算されました(Y軸)。VeriFi® Library Amplification Mix は、最高の阻害剤濃度でも最高の収率を維持します。
Phenol:フェノール
0.01、0.05、0.1 M フェノールでは、VeriFi® Library Amplification Mix は他のすべてのミックスと比較して高い増幅収率を示します。これは、100 mM フェノールで PCR 収率を維持する唯一のミックスです。これらの結果は、VeriFi® Library Amplification Mix がフェノールに対して最も耐性があることを示しています (図 2、左)。
SDS:ドデシル硫酸ナトリウム
SDS の最低濃度 (0.005%) では、VeriFi® Library Amplification Mix の増幅効率は他のミックスと同等です。VeriFi® Library Amplification Mix は、0.02% SDS でも活性を維持した唯一のポリメラーゼでした (図 2、中央)。したがって、VeriFi® Library Amplification Mix は強い耐性を示し、溶解ステップからの残留 SDS が存在する可能性があるサンプルに適していることを示唆しています。
Urea:尿素
VeriFi® Library Amplification Mix は、最大 0.2 M の尿素濃度を効果的に処理し、他のすべてのミックスと比較してパフォーマンスの低下はわずかしかありません。最高濃度 (0.5 M) では、VeriFi® Library Amplification Mix が活性を保持する唯一のミックスであり (図 2、右)、尿サンプルまたは尿素含有溶液で抽出されたサンプルの PCR における信頼性を示しています。
これらの観察結果を考慮すると、VeriFi® Library Amplification Mix は一般に、フェノール、SDS、および尿素に対して強力なパフォーマンスを示すと言えます。これらの化合物の濃度が高いとパフォーマンスが若干低下しますが、テストしたミックスの中で活性が維持される唯一のミックスであり、これらの阻害剤の濃度が高い場合でも、妥当なレベルの増幅効率を維持できます。
Tolerance to other inhibitors
私たちは主に臨床サンプルまたは抽出サンプルに含まれる主な阻害剤に焦点を当てましたが、他の一般的な PCR 阻害剤が VeriFi® Library Amplification Mix に与える影響もテストしました。表 2 では、VeriFi® Library Amplification Mix が 50% の PCR 収量を維持する、テスト済みの阻害剤濃度をまとめています。
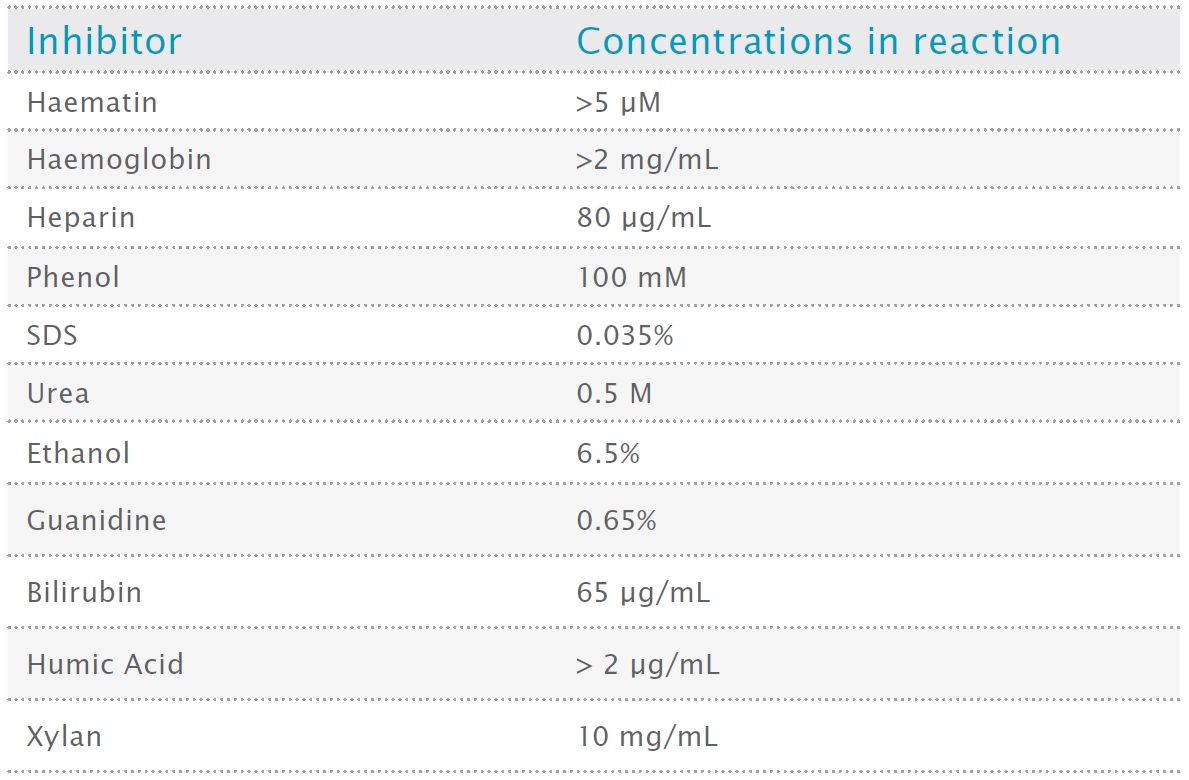
表2:VeriFi® Library Amplification Mix が非阻害反応の収率 50% を保持する最大阻害剤濃度。
Conclusion
VeriFi® Library Amplification Mix は、さまざまな PCR 阻害剤が存在する状況でも優れたパフォーマンスを発揮します。ヘパリン、ヘマチン、ヘモグロビンに対する耐性が強化されているため、血液由来のサンプルからの増幅に特に適しており、臨床診断や法医学アプリケーションで非常に役立ちます。SDS、フェノール、尿素に対する耐性により、複雑な生物学的混合物や調製が不十分な DNA サンプルなどの汚染物質が一般的となる PCR 検査での有用性がさらに広がります。堅牢な阻害剤耐性プロファイルを考慮すると、VeriFi® Library Amplification Mix は、困難な PCR に対する広範囲の問題解決ツールとして際立っています。これは、クローニングから NGS ライブラリーの増幅まで、下流のアプリケーションがどのようなものであっても、さまざまな阻害剤の存在下での PCR 増幅という課題に直面している研究者にとって最適な校正ポリメラーゼです。
Disclaimer & Product Use
この文書は査読を受けていません。
NEBNext Ultra II Q5 Master Mix および repliQa HiFi ToughMix は、それぞれ New England Biolabs および Quantabio の商標または登録商標です。
どの製品がお客様のアプリケーションに最適かご相談されたい場合、または VeriFi® Library Amplification Mix または VeriFi® Hot Start Mix の使用方法についてさらに技術的なアドバイスが必要な場合は、お問い合わせください。
