superior sensitivity and specificity in all probe-based real-time PCR assays
qPCRBIO Probe Mix 当社のユニバーサル プローブ qPCR キットは、TaqMan®、Scorpions®、分子ビーコン プローブなど、すべてのプローブベースのリアルタイム PCR アッセイで優れた感度と特異性を実現するように設計されています。
この堅牢で市場をリードするプローブ キットを使用すると、シングルプレックスまたはマルチプレックスの発現研究と診断アッセイを信頼性高く実行できます。最適化されたマスターミックスは、qPCR ベースのジェノタイピングおよび対立遺伝子識別研究にも適しています。この混合物は、qPCRBIO Probe Blue Mix
多重反応における高効率
早期の Ct 値に対する急速な伸長速度
市場をリードする感度 – 検出限界の向上
GCおよびATリッチ配列からの効率的な増幅
抗体媒介ホット スタート技術
すべてのリアルタイム PCR プラットフォームとの互換性
見やすい Blue Mix もラインナップ
絶対的な定量化
相対的遺伝子発現解析
TaqMan®、Scorpions®、および分子ビーコン プローブ
極度にコピー数の少ないターゲットの検出
リアルタイム PCR 診断
ジェノタイピングと対立遺伝子の識別
qPCRBIO Probe Mix は、プローブベースのリアルタイム PCR のすべてのニーズに応える強力な選択肢です。PCR Biosystems 社のユニバーサル キットを使用すると、コピー数の極めて少ないターゲットを確実に検出し、ゲノム、cDNA、ウイルス配列を含むあらゆる DNA テンプレートを定量化できます。
抗体媒介ホット スタート技術と最新のバッファー化学を組み合わせることで、最適化を最小限に、またはまったく必要とせずに、市場をリードするパフォーマンスを提供します。感度が向上した qPCRBIO Probe Mix は、マルチプレックス化に最適な選択肢になります。
qPCR 選択ツール
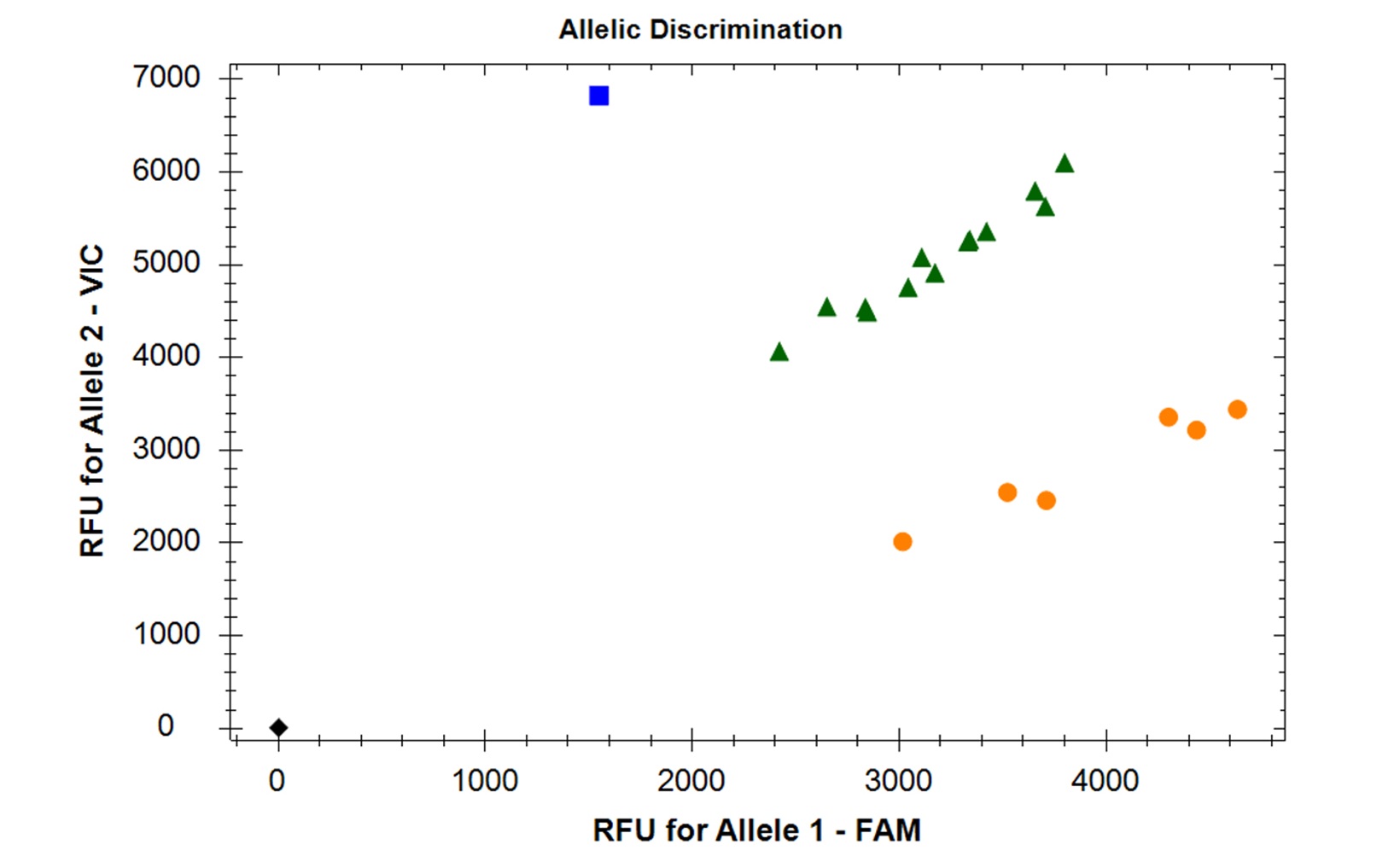
参考データ1:ジェノタイピングのための対立遺伝子識別 味覚2受容体メンバー38(TAS2R38)遺伝子のコドン262のSNP rs1726866用に設計されたTaqManプローブを二重反応(TアレルにはVICプローブ、CアレルにはFAMプローブ)に使用し、抽出したゲノムDNAから始めて、20人の被験者の集団でこの多型をスクリーニングしました。蛍光シグナルに基づいて、被験者はフェニルチオカルバミド(苦味)について、非味覚者(Tアレルに対してホモ接合、青い四角)、スーパーテイスター(Cアレルに対してホモ接合、黄色の円)、または中間味者(ヘテロ接合、緑の三角)に分類できます。黒いダイヤモンドは、テンプレートなしのコントロールを示します。PCRBIO Rapid Extract Lysis Kitを使用して上皮細胞(頬粘膜スワブ)から抽出したゲノムDNA 2μLを反応ミックスに追加しました。サイクル条件は、Biorad CFX 装置で 95°C 2 分、95°C 10 秒、60°C 30 秒の 50 サイクルでした。
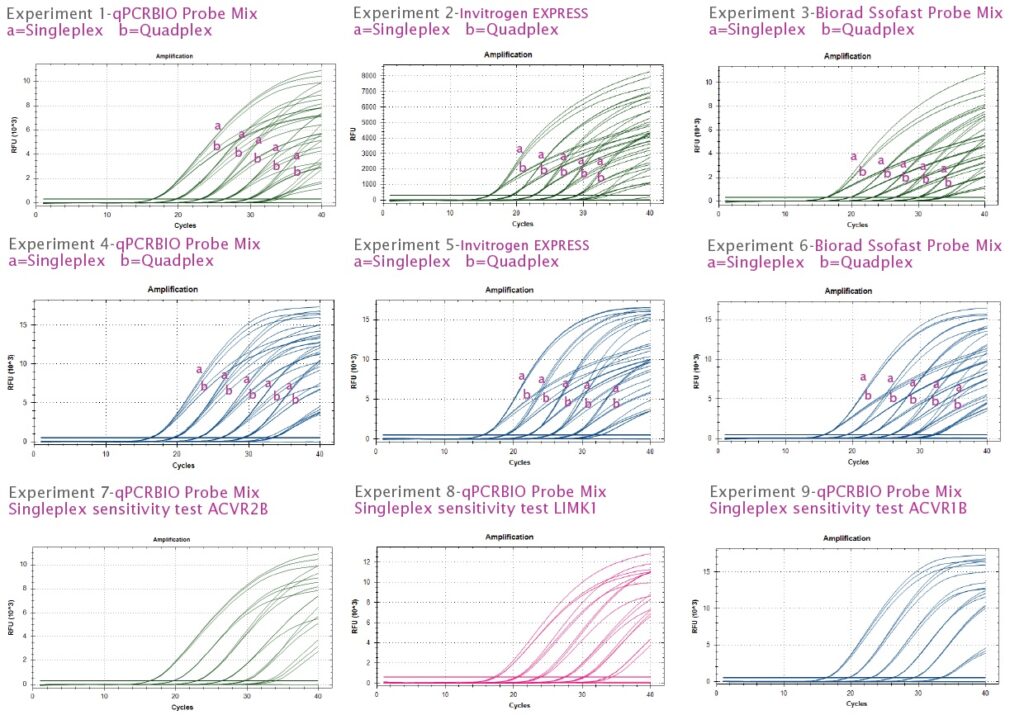
参考データ2:シングルプレックスアッセイおよびマルチプレックスアッセイにおける qPCRBIO Probe Mix の競合他社との比較 実験 1、2、3 は、cDNA 希釈系列からのシングルプレックスおよびクアッドプレックス (ACVR2B、LIMK1、ACVR1B、CDK7) でのヒト遺伝子 ACVR2B の TaqMan プローブ増幅トレースを示しています。a) トレースはシングルプレックス反応を示し、b) トレースはクアッドプレックス反応を示しています。qPCRBIO プローブ ミックスは、Invitrogen (実験 2) および Biorad (実験 3) の最新の競合ミックスと比較してテストされました。qPCRBIO プローブ ミックスは、Invitrogen および Biorad のミックスと比較して、マルチプレックスの場合に PCR 阻害が最も少ないことを示しています。これは、シングルプレックス (a) と比較してクアッドプレックス (b) でより遅延した増幅トレースで明らかです。実験 4、5、6 は、シングルプレックスおよびクアッドプレックス (ACVR2B、LIMK1、ACVR1B、CDK7) でのヒト遺伝子 LIMK1 の TaqMan プローブ増幅トレースを示しています。実験 1、2、3 と同様に、PCR Biosystems プローブ ミックスでは、テストした競合他社のミックスに比べて、LIMK1 増幅のマルチプレックスでの阻害が少なくなっています。サイクリング条件は、Biorad CFX 機器で 95°C 2 分、95°C 10 秒、60°C 15 秒の 40 サイクルでした。
実験 7、8、9 は、1×106 コピーから 10 コピーの DNA までのプラスミド希釈系列からの TaqMan プローブ増幅トレースを示しています。各遺伝子について、qPCRBIO プローブ ミックスは 100% の効率で増幅し、10 コピーの DNA を検出しました。
qPCRBIO Probe Mix Lo-ROX
qPCRBIO Probe Mix Hi-ROX
qPCRBIO Probe Mix Separate-ROX
qPCRBIO Probe Mix で生成された生成物は、消化、クローン化、およびシーケンスできますか?
はい、qPCRBIO Probe Mix で生成された PCR 産物は、野生型 Taq ポリメラーゼで生成された PCR 産物と同じ特性を持っています。標準プロトコルを使用して、制限エンドヌクレアーゼで配列決定または消化することができます。産物は 3′-d(A) 末端で、TA クローニングに使用できます。また、クローニング前に平滑末端にしたり、制限酵素で消化したりすることもできます。最良の結果を得るには、標準的な PCR クリーンアップ キットを使用して PCR 産物を精製することをお勧めします。
ROX は反応に悪影響を及ぼす可能性がありますか?
ROX (6-carboxy-X-rhodamine) は、主にウェル間の光路のばらつきによって生じる蛍光レベルの変動を正規化するために、ROX 依存型リアルタイム PCR 機器でパッシブ リファレンス 色素として使用されます。蛍光強度 (Rn) の正規化は、リアルタイム PCR ソフトウェアで、特定の信号の発光強度を ROX の発光強度で割ることによって行われます。
ROX は PCR 反応には関与せず、その蛍光レベルは各ウェルの DNA の量に比例しないため、この蛍光体を混合物に追加すると、増幅中に一定の蛍光信号が得られます。
パッシブ リファレンス スタンダードを必要とするさまざまなタイプのリアルタイム PCR 機器では、主に各システムの光学構成 (つまり、使用される励起源と光学系の種類) が異なるため、ROX の最適濃度が異なります。
ROX の添加量が少なすぎたり多すぎたりすると、非常にノイズの多い信号になり反応の結果に影響を及ぼすため、お客様にとって次のことが非常に重要です:
リアルタイム PCR の結果を最適化するために適切な ROX 濃度を決定する
反応を設定するために使用するソフトウェアで ROX 設定を確認する
最も一般的に使用されるシステム用の便利な選択ツール
DNAを細菌(コロニーPCR)またはウイルス粒子から単離する必要がある場合、95℃での活性化ステップを15分に延長できますか?
はい。通常の活性化時間である 2 分では、細菌またはウイルスのサンプルから DNA を確実に放出させるには時間が足りません。活性化ステップは、反応収率に影響を与えずに 15 分まで延長できます。
qPCRBIO Probe Mix には FAM 色素が含まれていますか?
いいえ。ROX 以外に、当社のミックスには他の色素は含まれていません。したがって、反応には任意の蛍光体結合プローブを使用できます。qPCRBIO Probe Blue Mix を使用している場合は、それぞれの製品マニュアルの表 1 を参照して、青色色素が蛍光色素分子の蛍光を妨げないことを確認してください。
qPCRBIO Probe Mix の蛍光が競合他社の製品で得られたものと異なるのは正常ですか?
製品によって蛍光のプラトーが異なる場合があります。ただし、これは定量精度には影響せず、製品間の Ct 値の違いはありません。
サンプル DNA を 1x TE (10 mM Tris-HCl / 1 mM EDTA) バッファーに保存すると、qPCRBIO SyGreen Blue Mix を使用した後続の qPCR と互換性がありますか?
はい、この保存バッファーは互換性があります。EDTA は混合物中のマグネシウムの一部をキレート化しますが、反応に大きく影響するほどではありません。
qPCRBIO Probe Mix の ROX 濃度はどれくらいですか?
パッシブリファレンス色素を含む qPCRBIO SyGreen ミックスは、異なる配合で提供され、それぞれ異なる濃度のパッシブリファレンス色素を含みます。
qPCRBIO Probe Mix Lo-ROX には 112 nM ROX が含まれています。
qPCRBIO Probe Mix Hi-ROX には 1.12 µM ROX が含まれています。
qPCRBIO Probe Mix No-ROX には ROX は含まれていません。
qPCRBIO Probe Mix Separate-ROX 2x ミックスには ROX が含まれておらず、50 µM ROX 添加剤の別のチューブが含まれています。これにより、使用する ROX の濃度を選択できます。
qPCR 選択ツール
qPCRBIO Probe Mix には何が含まれていますか?
qPCRBIO Probe Mix は、すぐに使用できる qPCR 2x マスターミックスです。反応のセットアップ時にプライマー、テンプレート DNA、PCR グレードの水を追加するだけです。
ROX とは何ですか? それは必要ですか?
ROX はパッシブリファレンス色素であり、PCR 反応には関与しません。PCR に関連しない蛍光の変動を標準化するために使用されます。「リソース」セクションの qPCR 選択ツール
qPCRBIO Probe Mix の dNTP 濃度はどれくらいですか??
すべての qPCRBIO Probe Mix には、2 mM の濃度 (ぞれぞれ 0.5 mM)で dNTP が含まれています。つまり、反応の最終濃度は 1 mM (ぞれぞれ 0.25 mM)です。
qPCRBIO Probe Mix の MgCl2 濃度はどれくらいですか??
すべての qPCRBIO Probe Mix には、12 mM の濃度で MgCl2 が含まれています。つまり、反応の最終濃度は 6 mM です。
ROX による信号の正規化が競合他社のミックスと比較して低いと思われる場合は、何を考慮する必要がありますか?
異なる機器には異なる ROX 濃度が必要なため、正しい濃度の ROX を使用していることを確認してください。たとえば、Lo-ROX ミックスを必要とする機器で qPCRBIO Probe Mix を使用すると、ソフトウェアは qPCRBIO 信号を Hi-ROX レベルに対して正規化します。この場合、競合他社に Lo-ROX ミックスが選択されていたとすると、競合他社のミックスに比べて qPCRBIO ミックスの蛍光レベルが大幅に低下します。
異なるメーカーのミックスを比較する場合は、データを分析する前に、別々に実行するか、パッシブ リファレンスをオフにすることをお勧めします。
標準希釈により増幅効率が低下した場合、どのようなトラブルシューティングが推奨されますか?
標準曲線の希釈度が上がると効率が低下することが報告されています。これを回避するには、標準を 10 mM Tris-HCl pH 8.0、0.1 mM EDTA、0.05% Tween-20 で希釈することをお勧めします。EDTA はキレート剤で、DNAse 活性を防ぐ役割を果たします[1]。Tween-20 は界面活性剤であり、DNA がチューブの側面に吸着するのを防ぎます[2]。ほとんどのマイクロ遠心分離機はポリプロピレン製で、DNA はポリプロピレンに非常によく付着することが研究で実証されています[3]。
標準物質は希釈後に凍結しないでください。界面活性剤の存在下であっても、凍結により DNA がポリプロピレンに不可逆的に結合するようです。標準物質を 4°C で保存し、数週間ごとに新しいバッチを準備することをお勧めします。
Barra, G. B. et al. EDTA-mediated inhibition of DNases protects circulating cell-free DNA from ex vivo degradation in blood samples. Clin Biochem 48 , 976-981, doi:10.1016/j.clinbiochem.2015.02.014 (2015).
Linnarsson, S. Recent advances in DNA sequencing methods – general principles of sample preparation. Exp Cell Res 316 , 1339-1343, doi:10.1016/j.yexcr.2010.02.036 (2010).
Gaillard, C. & Strauss, F. Avoiding adsorption of DNA to polypropylene tubes and denaturation of short DNA fragments. Technical Tips Online 3 , 3 (1998).
反応が阻害されている場合に推奨されるトラブルシューティングは何ですか?
阻害が観察された場合、反応中のテンプレートの量を減らすことができます。これにより Ct 値は増加しますが、Taq DNA ポリメラーゼの活性を阻害する阻害剤の可能性は低くなります。これが機能しない場合は、反応に 0.4~4 mg/ml の BSA を追加してみてください[1]、[2]。製品マニュアルのサイクリング条件が遵守されていることを確認してください。
Kreader, C. A. Relief of amplification inhibition in PCR with bovine serum albumin or T4 gene 32 protein. Appl Environ Microbiol 62 , 1102-1106 (1996).
Wilson, I. G. Inhibition and facilitation of nucleic acid amplification. Appl Environ Microbiol 63 , 3741-3751 (1997).
qPCRBIO Probe Mix を使用したときに非特異的な生成物がある場合、どのようなトラブルシューティングが推奨されますか?
反応を最適化する際には、さまざまなオプションを考慮する必要があります。
アニーリング/伸長時間を5秒に短縮する
アニーリング/伸長温度を60℃から65℃に上げる
DNA テンプレートを希釈するには、まず 5 ng の DNA から始めて、10 倍のテンプレート希釈シリーズを使用します。これらを電気泳動にて非特異的な産物が残っているかどうかを確認するだけでなく、テンプレート希釈を行った後、qPCR 機器のソフトウェアを使用して反応の効率を計算することもできます。効率が 90 ~ 110% の場合、アンプリコンはサイクルごとに 2 倍になっています。
Ct 値が通常より高い場合、どのようなトラブルシューティングが推奨されますか?
Ct 値が高い場合、一般的に増幅が遅れていることを示します。これは、反応中のテンプレートが過剰で、プライマーとプローブが異なる DNA 分子に結合していることが原因である可能性が最も高いと考えられます。サンプルには通常、ターゲット遺伝子以外の DNA が多く含まれており、オリゴが散乱する可能性があります。この問題を解決するには、サンプルを希釈 (10 倍~1000 倍) することをお勧めします。
さらに、アニーリング/伸長温度を上げることで、オリゴの結合をターゲット配列にさらに特異化し、バックグラウンド信号を減らすこともできます。
マルチプレックスを行う場合、各プライマーの推奨濃度はどれくらいですか?
各プライマーを 0.4 µM で使用することをお勧めします。この推奨濃度にはある程度の柔軟性がありますが、プライマー濃度を上げないでください。酵素の活性に重大な影響を与える可能性があります。
競合他社の製品と同じプライマーと PCR 条件を使用した場合に、非特異的な生成物が発生するのはなぜですか?
おそらく、最初のステップ (ホット スタート) の時間が短すぎることが原因です。酵素を完全に活性化するには、ホット スタート段階を 95°C で 2 分間行うようにしてください。推奨される温度プロファイルは次のとおりです。
95°C (120 seconds)
40 cycles: 95°C (5-15 seconds) – 60°C (20-30 seconds)
Melt
それでも非特異的な生成物が得られる場合、使用するプライマー セットに応じて、アニーリング/伸長温度を 60°C から 65°C に上げることをお勧めします。