スペクトルの制限を克服し、マルチプレックスqPCRおよびRT-qPCRアッセイにおける検出を改善する
Constantine Garagounis PhD and Matteo Beretta PhD
Introduction
マルチプレックス qPCR は、(スペクトル的に異なる蛍光色素を使用して) 複数のターゲットを一度に識別するために一般的に使用される手法です。ただし、選択したプローブ色素や機器の制限によって制限されることがあります。このアプリケーション ノートでは、Clara® AquaPlex qPCR Mix を使用してマルチプレックス qPCR の検出を改善する方法について説明します。
マルチプレックス反応で最も一般的なプローブ色素の 1 つは、シアニン 5 色素 (Cy5) です。これは、635/665 nm で励起/発光極大を示す遠赤色蛍光色素です。Cy5 は、FAM 色素や HEX 色素などの他の一般的なプローブ蛍光体とはスペクトル的に異なります。ただし、Cy5 色素で標識されたプローブは、他の色素とターゲットの組み合わせと比較して、蛍光プラトーが低くなることが多く、その結果、ターゲット増幅の遅延につながります。この効果の正確なメカニズムは十分に説明されていませんが、他の一般的に使用される色素と比較して、同じチャネルで使用される (つまり、同様の励起および発光ピークを持つ) 蛍光体の Cy5[1] の量子収率が低いことが原因であると考えられます。
Cy5 以外の異なる蛍光体を選択すれば、この問題を回避することができます。ただし、このアプローチの問題は、多くのリアルタイム機器で利用できる検出チャネルの数が限られていることです。これは、多くの機器がシグナルを正規化するためにパッシブリファレンス色素の使用を必要とするという事実によってさらに制限され、プローブ蛍光検出に利用可能なチャネルの数がさらに減少します。
従来、ROX (6-carboxy-X-rhodamine) はパッシブ参照染料として使用され、この目的に利用できる最も一般的なオプションです。578/604 nm の励起/発光最大値を持つ ROX は、他の一般的に入手可能なプローブ色素、たとえば、Texas Red (596/615 nm) や CalRed 610 (590/610 nm) との使用に適した検出チャネルを占めます。
Clara® AquaPlex Mix は ROX を含まず、代わりに Cy5 用チャネルで励起および発光が最大となるパッシブ リファレンス ダイを使用します。これらの Mix を使用すると、Cy5 検出チャネルを受動的な参照データ収集用に占有し、ROX チャネルを解放してターゲット検出や蛍光強度に悪影響を及ぼさない他の色素を使用できるようになり、qPCR アッセイを改良する機会が得られます。
このアプリケーション ノートでは、マルチプレックス qPCR を実行する際に Cy5 チャネルでパッシブ リファレンス ダイを使用することの明確な利点を示します。マルチプレックス検出で Cy5 ラベル プローブを Texas Red ラベル プローブに置き換えた場合の影響を調査するために、DNA および RNA サンプルのさまざまなマルチプレックス qPCR 反応で Clara® Probe 1-Step Mix No-ROX と Clara® Probe 1-Step Mix AquaPlex のパフォーマンスを比較しました。
Materials & Methods
Primer and template preparation
3 つのターゲットに対するオリゴヌクレオチドを含むプライマー セットは、反応中の各プライマーの最終濃度が 400 nM、各プローブの最終濃度が 200 nM になるように、10 μM プライマー (F + R) 400 μL を 10 μM プローブ 200 μL に混合して調製しました。以下の 4 セットのプライマーとプローブを準備しました:
- Sars-CoV-2 E 遺伝子 (FAM)、インフルエンザ A (HEX)、マウス B2M (Texas Red)
- Sars-CoV-2 E 遺伝子 (FAM)、インフルエンザ A (HEX)、マウス GAPDH (Cy5)
- Sars-CoV-2 E 遺伝子 (FAM)、インフルエンザ A (HEX)、マウス GAPDH (Texas Red)
- Sars-CoV-2 E 遺伝子 (FAM)、インフルエンザ A (HEX)、マウス B2M (Cy5)
テンプレート希釈率は、各ターゲットの 20,000、4,000、400、40、4 コピーで使用しました。テンプレートなしのコントロールも含まれていました。各サンプルに対して 3 つの技術的複製が実行されました。

表1:使用したプライマー、プローブおよびターゲット
Reaction setup
Qiagen QIAgility ロボットを使用して、以下を含む最終体積 20 μL で反応をセットアップしました。
8.8 μL Milli-Q 水、5 μL 4x Clara® Probe Mix No-ROX または 4x Clara® Probe Mix AquaPlex、1.2 μL の各プライマー/プローブミックス (上記) と 5 μL のサンプル (表 2)。
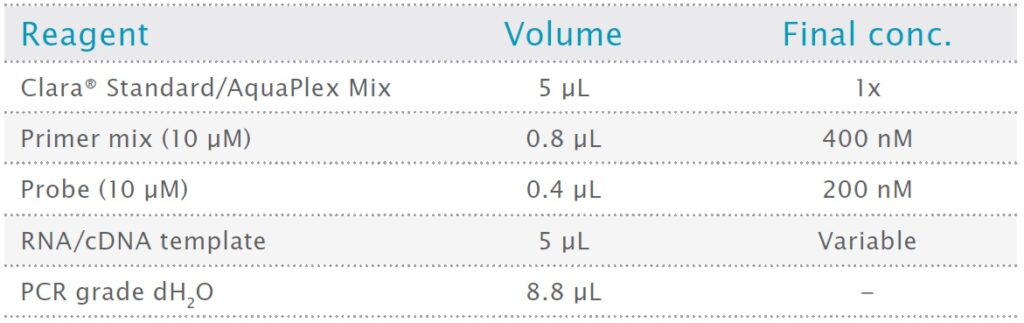
表2:反応のセットアップと構成
Cycling conditions
増幅は、Bio-Rad CFX96 Touch qPCR 装置で次のように実行されました。
45 °C 20 分 (逆転写、DNA ターゲットは省略)、95 °C 2 分 (初期変性)、続いて 95 °C 15 秒 (変性) および 60 °C 30 秒 (アニーリング伸長) の 2 ステップ サイクルを 50 回。各サイクルの最後に蛍光測定値を取得しました。
Results
Clara® Probe 1-Step Mix No-ROX と Clara® Probe 1-Step Mix AquaPlex を使用して、RNA テンプレートから 3 つのターゲットの 2 つの異なるセットを増幅しました。Clara® Probe Mix No-ROX と Clara® Probe Mix AquaPlex を使用した別の 3 本鎖 qPCR 反応で、cDNA テンプレートから同じ 3 つのターゲットのセットを増幅しました (表 1)。最初の RNA ターゲットのセットには、β -2-ミクログロブリン (B2M)、SARS-CoV-2 E 遺伝子 (E-Gene)、およびインフルエンザ A (Inf A) が含まれ、2 番目のセットには、グリセルアルデヒドリン酸脱水素酵素 (GAPDH)、E-Gene、および Inf A が含まれていました。
E 遺伝子および Inf-A ターゲットは、増幅が標準の Clara® Probe 1-Step Mix (Clara® Standard) または Clara® Probe 1-Step Mix AquaPlex (Clara® AquaPlex) のどちらを使用して行われたかに関係なく、それぞれ FAM および HEX 蛍光体で標識されたプローブで検出されました。B2M および GAPDH は、Clara® Standard を使用した場合は Cy5 標識プローブで、Clara® AquaPlex を使用した場合は Texas Red 標識プローブで検出されました。これは、RNA テンプレートと cDNA テンプレートの両方で当てはまりました。重要なのは、GAPDH および B2M のプローブの配列は変更されておらず、蛍光体のみが変更されたことです。
RNA テンプレートから最初のターゲット セットを増幅する場合、すべての希釈度で許容できる増幅曲線が得られました。E-Gene と Inf-A の平均 Cq は、増幅にどの Mix を使用したかに関係なく、すべてのテンプレート希釈度で実質的に同一であり、効率も同等でした。ただし、Clara® AquaPlex Mix の Texas Red 標識プローブを使用した場合、Clara® Standard Mix の Cy5 標識プローブを使用した場合と比較して、B2M は増幅が著しく改善され、増幅プラトー フェーズではるかに強い蛍光を示しました (図 1)。
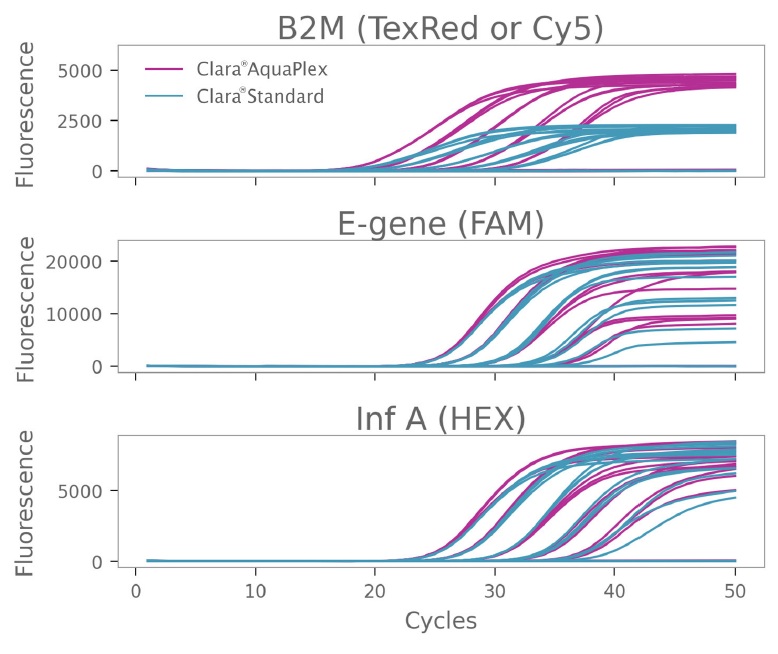
図1:Clara® Probe 1-Step Mix AquaPlexによるRNAターゲットの増幅の改善
ハウスキーピング遺伝子 B2M (β -2-ミクログロブリン)、SARS-CoV-2 E-Gene、およびインフルエンザ A の 3 重増幅。増幅は Clara® Probe 1-Step Mix AquaPlex および Clara® Probe 1-Step Mix No-ROX を使用して実施しました。B2M 検出用プローブは、Clara® AquaPlex Mix を使用する場合は Texas Red で、Clara® Standard Mix を使用する場合は Cy5 で標識しました。E-Gene および Inf A のプローブ色素は同じままでした。全 RNA テンプレートの 5 段階希釈を使用しました。総反応容量は 20 μL でした。サイクル条件は、45 °C 20 分、95 °C 2 分、および 95 °C 15 秒、60 °C 30 秒の 50 サイクルでした。Clara® AquaPlex Mix で Texas Red プローブを使用すると、B2M 増幅が改善されました。
2 番目のターゲット セットを増幅する場合も同様の効果が見られました。Clara® AquaPlex の Texas Red ラベル プローブを使用した場合、Clara® Standard ミックスの Cy5 ラベル プローブを使用した場合と比較して、GAPDH の Cqs は低く、蛍光は高くなりました。増幅に使用したミックスに関係なく、E-Gene と Inf-A の検出は変わりませんでした (図 2)。
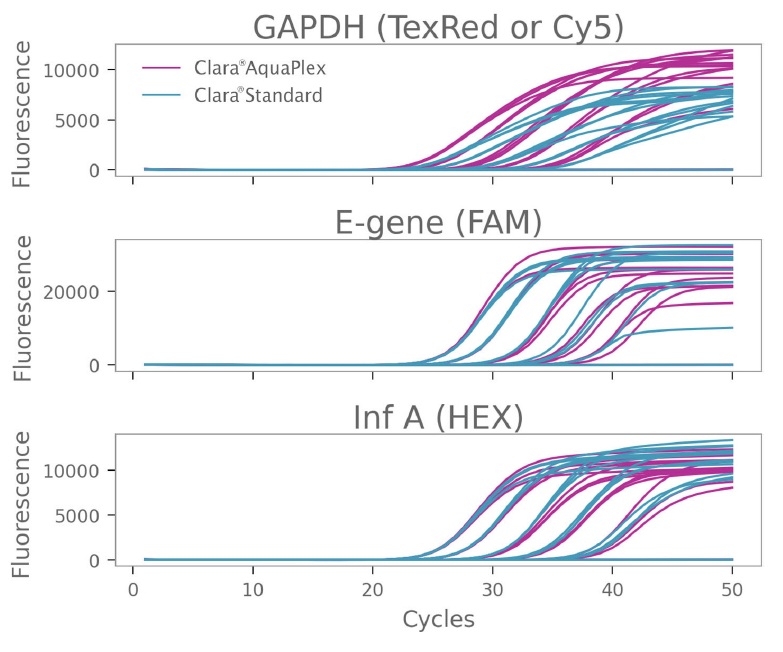
図2:Clara® Probe 1-Step Mix AquaPlexによるRNAターゲットの増幅の改善
ハウスキーピング遺伝子 GAPDH、SARSCoV-2 E-Gene、およびインフルエンザ A の 3 重増幅。増幅は Clara® Probe 1-Step Mix AquaPlex および Clara® Probe 1-Step Mix No-ROX を使用して実施しました。GAPDH 検出用プローブは、Clara® AquaPlex Mix を使用する場合は Texas Red で、Clara® Standard Mix を使用する場合は Cy5 で標識しました。E-Gene および Inf A のプローブ色素は同じままでした。全 RNA テンプレートの 5 段階希釈を使用しました。総反応容量は 20 μL でした。サイクル条件は、45 °C 20 分、95 °C 2 分、および 95 °C 15 秒、60 °C 30 秒の 50 サイクルでした。Clara® AquaPlex Mix で Texas Red プローブを使用すると、GAPDH 増幅が改善されました。
当然のことながら、Texas Redと Cy5 シグナルの正規化された蛍光強度を比較すると、Cq 検出の改善は、B2M を検出する際のTexas Red色素の蛍光強度が高いためであることが明らかになりました。ただし、GAPDH の場合、Texas Red色素では Cq 値も低く、プローブによるターゲットの検出は、場合によっては Cy5 以外の色素を使用することで改善される可能性があることを示唆しています。ただし、これはターゲット固有の方法で発生します (図示せず)。
このターゲット検出の改善は、各希釈度での各ターゲットの平均 Cq を比較した場合にも明らかです。最初のターゲット セットの平均 Cq を比較すると、Clara® AquaPlex と Clara® Standard Mix を使用した場合、E-gene と Inf-A の増幅では Cq の差 (デルタ Cq) が 0.5 未満になりましたが、GAPDH 増幅では、すべてのターゲット希釈度で同じ Cq の差が 1 を超えました (図 3)。
図3:Clara® Probe 1-Step Mix AquaPlex は、ROX チャネル プローブ色素によるターゲット検出を改善する
図 1 に示した増幅プロットから抽出した Cq 値を、B2M (β -2-ミクログロブリン)、SARSCoV-2 E-Gene、およびインフルエンザ A のターゲットコピー数に対してプロットしました。Texas Red 標識プローブ (Clara® AquaPlex) と Cy5 標識プローブ (Clara® Standard) を差し引いた B2M 検出の Cq 値の差が右下のグラフに示されています。Clara® AquaPlex で Texas-Red プローブを使用すると、すべてのターゲット濃度で 1 サイクル以上早く検出できました。
cDNA テンプレートから両方のターゲット セットを増幅した場合も、実質的に同じ結果が得られました。これらのターゲットを Clara® AquaPlex で増幅し、Texas Red ラベルのプローブで検出した場合、Clara® Standard ミックスで増幅し、Cy5 結合プローブで検出した場合と比較して、GAPDH の増幅は大幅に改善されました (図 4)。一方、B2M の増幅はわずかに改善されました (図 5)。E-gene と Inf-A は、どのミックスを使用したかに関係なく、同様の増幅パターンを示しました (図 4 と 5)。
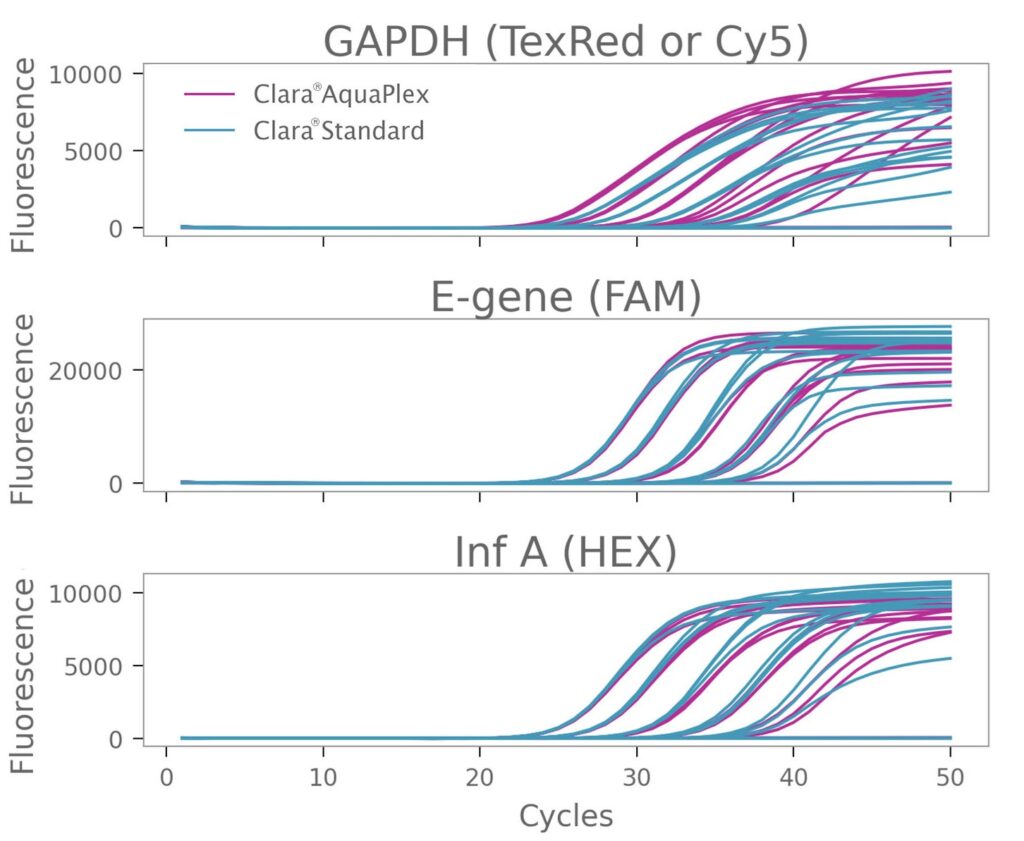
図4:Clara® Probe Mix AquaPlexによるDNAターゲットの増幅の改善
ハウスキーピング遺伝子 GAPDH、SARSCoV-2 E-Gene、およびインフルエンザ A の 3 重増幅。増幅は Clara® Probe Mix AquaPlex および Clara® Probe Mix No-ROX を使用して実施しました。GAPDH 検出用プローブは、Clara® AquaPlex Mix を使用する場合は Texas Red で、Clara® Standard Mix を使用する場合は Cy5 で標識しました。E-Gene および Inf A のプローブ色素は同じままでした。全 RNA テンプレートの 5 段階希釈を使用しました。総反応容量は 20 μL でした。サイクル条件は、95 °C 2 分および 95 °C 15 秒、60 °C 30 秒の 50 サイクルでした。Clara® AquaPlex Mix で Texas Red プローブを使用すると、GAPDH 増幅が改善されました。
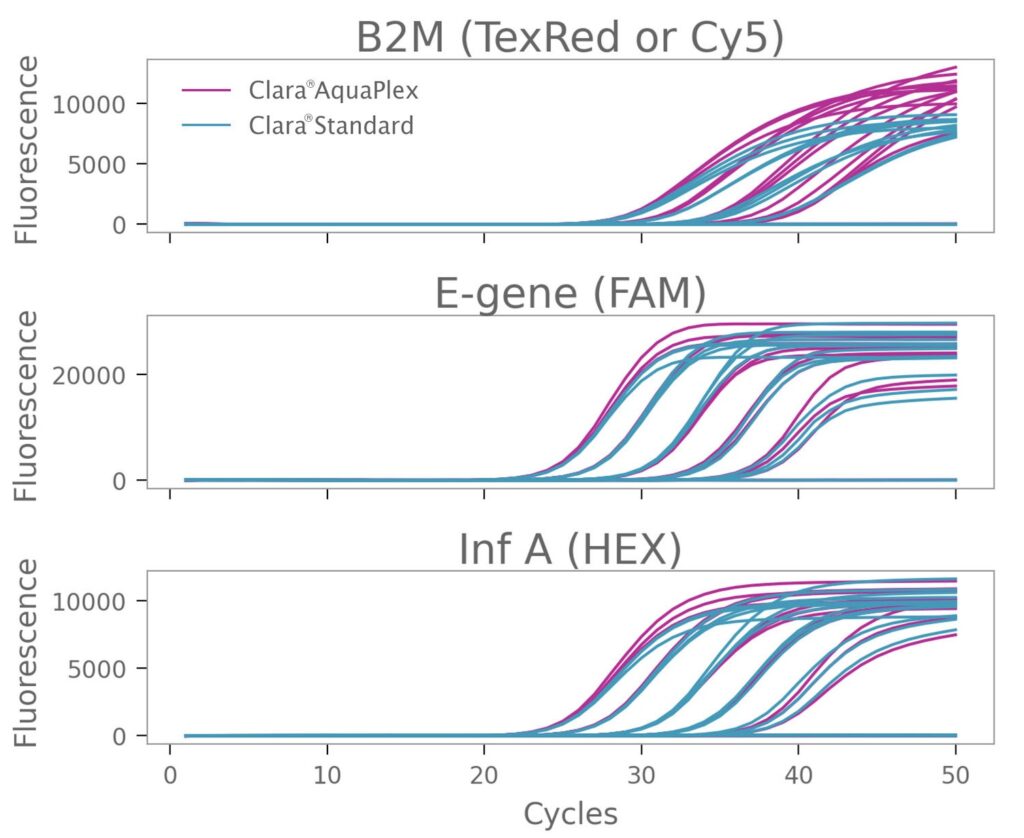
図5:Clara® Probe Mix AquaPlexによるDNAターゲットの増幅の改善
ハウスキーピング遺伝子 B2M (β -2-ミクログロブリン)、SARS-CoV-2 E-Gene、およびインフルエンザ A の 3 重増幅。増幅は Clara® Probe Mix AquaPlex および Clara® Probe Mix No-ROX を使用して実施しました。B2M 検出用プローブは、Clara® AquaPlex Mix を使用する場合は Texas Red で、Clara® Standard Mix を使用する場合は Cy5 で標識しました。E-Gene および Inf A のプローブ色素は同じままでした。全 RNA テンプレートの 5 段階希釈を使用しました。総反応容量は 20 μL でした。サイクル条件は、95 °C 2 分および 95 °C 15 秒、60 °C 30 秒の 50 サイクルでした。Clara® AquaPlex Mix で Texas Red プローブを使用すると、B2M 増幅が改善されました。
Discussion
これらの結果は、Cy5 を Texas Red (または類似の染料) 標識プローブに置き換えると、マルチプレックス qPCR アッセイのパフォーマンスが向上するという説得力のある証拠を提供します。この置き換えは、受動参照として ROX の代わりに Clara® AquaPlex Mix を使用することで促進され、B2M や GAPDH などのターゲットの検出感度と蛍光強度が大幅に向上します。
重要な発見の 1 つは、AquaPlex Mix で Texas Red ラベルのプローブを使用して検出されたターゲットの Cq 値と蛍光プラトーが一貫して改善されたことです。この改善のほとんどは、蛍光レベルが高いこと (Cy5 よりも量子収率が高いため) によるものです。ただし、他のメカニズム (プローブの安定性や他の反応成分との相互作用など) が関与している可能性があり、Cy5 ラベルのプローブを使用すると異なる結果になることがあります。
Clara® AquaPlex Mix の使用により、ROX チャネルを、Cy5 と同じ検出の問題を示さない同じ励起/発光の蛍光体 (Texas Red、CalRed610、ROX 自体) と結合したプローブに再割り当てできます。この再構成により、マルチプレックス qPCR アッセイの検出性能が大幅に向上し、qPCR で Cy5 を使用する際の大きな制限の 1 つが解消されます。
Conclusion
結論として、Clara® ProbeとClara® Probe 1-Step Mix AquaPlexは、Cy5 標識プローブに関連する課題を軽減することで、マルチプレックス qPCR および 1 ステップ RT-qPCR アッセイの大幅な改善を示しました。Clara® AquaPlex Mix の使用により可能になった Cy5 標識プローブを Texas Red に置き換えると、蛍光強度が高まり、(ターゲット依存的に) ターゲット増幅が向上し、最終的に検出の感度と信頼性が向上しました。これにより、Cy5 プローブ染料による検出の低さの問題を直接解決できます。
Clara® AquaPlex Mix への移行は、現在の qPCR セットアップのスペクトル制限を克服するための実用的なソリューションを提供し、追加の検出チャネルを備えた機器への高価なアップグレードの必要性を減らす可能性があります。
Implementation Considerations
すべての機器でパッシブリファレンス色素設定を変更できるわけではありません。機器の製品マニュアルを参照するか、メーカーに問い合わせて、変更が可能かどうかを確認してください。適切なパッシブリファレンス色素は、互換性のある機器では「Cy5」または「Mustang Purple」と表示されている場合があります。当社のqPCR 選択ツールは、Clara® Probe Mix および AquaPlex Mix と互換性がある、流通している最も一般的な機器のいくつかを示しています。
References
- R. B. Mujumdar 1, L. A. Ernst, S. R. Mujumdar, C. J. Lewis, A. S. Waggoner, Cyanine dye labelling reagents: sulfoindocyanine succinimidyl esters, 1993 Mar-Apr;4(2):105-11. doi: 10.1021/bc00020a001.
