細胞内カルシウムの測定・カルシウム動態

概要
細胞内カルシウムは、イオンチャネルとGタンパク質共役型受容体の活性化状態、およびアポトーシスと細胞損傷の段階の重要な指標になっています。それぞれの動態とカルシウムレベルの絶対量は、これらの生理学的プロセスごとに異なりますが、それらをモニタリングするための実験方法があります。
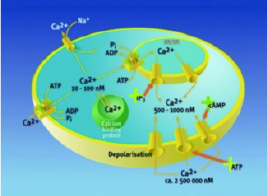
二価カルシウムは、多くの真核生物のシグナル伝達経路における細胞内メッセンジャーです。ほとんどのカルシウムシグナル伝達システムには、1つの共通点があります:それらはカルシウムの短いパルスを生成し、それによって細胞機能を調節します。カルシウムはリン酸化およびカルボキシル化化合物と不溶性の複合体を形成することが多いため、カルシウムの細胞内レベルは通常低く保たれます。通常、細胞質ゾルのカルシウム濃度は100nMです。細胞が刺激を受けると、カルシウムイオンは能動的に細胞内に取り込まれます。筋肉収縮、神経伝達シグナル、ホルモン分泌、細胞運動のような反応はすべてカルシウムイオン濃度の変化に依存しています。
種類
| 標識 | 測定モード | 励起波長 | 測定波長 |
| Fluo-3 | 蛍光 | 485 | 535 |
| Fluo-4 | 蛍光 | 485 | 535 |
| Fura-2 | 蛍光二波長 | 340 / 390 | 510 |
| Fura-Red | 蛍光二波長 | 485 | 600 / 660 |
| Indo-1 | 蛍光二波長 | 355 | 405 / 485 |
| Aequorine | フラッシュ型発光 | – | – |
細胞内カルシウムを発光で測定する
Aequorine のフラッシュ型発光反応による細胞内カルシウムレベルのモニタリングは非常に効率的です。イノシトールリン脂質分解を誘発するGタンパク質共役受容体 (GPCRまたは7TM受容体としても知られる) の活性化と電位依存性カルシウムイオンチャネルの活性 (後者はかなり遅い流入を引き起こす) の両方のアッセイは、プレートルミノメーターCentro LB963 あるいは マルチモードプレートリーダー TriStarシリーズのJETインジェクターを使用して測定します。
細胞内カルシウムを蛍光で測定する
無傷の細胞内の遊離カルシウムの濃度は、Fura-2やIndo-1などの多環式キレート剤を使用してモニタリングできます。 Fura-2、Indo-1やFura-Redはレシオメトリックな読み取りを行い、それによって色素の漏れや褪色、またはアッセイ条件の変化によって引き起こされる影響を軽減します。カルシウムが結合すると、それぞれ色素の蛍光特性が著しく変化するため、特定のシグナル伝達経路に応じたカルシウムフラックスを直接検出することが可能になります。 Indo-1からの最大発光は、カルシウムを含まない培地での約475 nmから、色素がカルシウムで飽和している場合の約400nmにシフトします。 Fura-2を使用すると、カルシウムを結合するとFura-2の最大吸収が380nmから340nmにシフトしますが、蛍光は510nmで一定に保たれます。これにより、蛍光強度が逆に変化します。340nmで増加し、380nmで減少します。
Berthold Technologies社のマルチモードプレートリーダーのフィルター切り替えは非常に高速 (約150 ms) であるため、カルシウム濃度の急激な変化をモニタリングする際に高解像度での検出が可能になります。少なくとも1つのJETインジェクターを使用して、高速反応速度を監視できます。
Fluo-3やFluo-4は細胞内カルシウムの変化をモニタリングするためにも使用でき、1回の測定で使用できるという利点があるため、フィルターを交換する必要はありません。これは、細胞内カルシウムレベルの変化が非常に速い場合 (たとえば、モノクロメーターを使用している場合やフィルターの切り替えが遅い場合) に役立ちます。ただし、レシオメトリックではないため、アッセイ条件の変化、漏れ、褪色による影響が発生しやすくなります。
一般的な手順
- 細胞に蛍光標識する
- 細胞の基底状態を測定する
- 刺激薬物を分注し、すぐに繰り返し測定する
- イオン透過担体を分注し、しばらく安置してから最大レスポンスを測定する



