マルチプレックスプローブベースの qPCR を使用したサル痘ウイルスの迅速な検出のためのテストパネル
Matteo Beretta PhD & Constantine Garagounis PhD
Introduction
ウイルス性Mpox感染症の発生は、2022年5月[1]、つまりコロナウイルスの世界的大流行の終息時に確認されました。最初の症例は、2022年5月6日にロンドンで発見され[2]、ナイジェリアから帰国した患者でした。その直後、世界中のいくつかの国で症例が報告され、ヨーロッパと北米での発生率が高く、Mpoxがもともと流行していた中央アフリカと西アフリカ以外で初めて広がったことを示しています[1]。7月23日、世界保健機関(WHO)は、この流行を国際的に懸念される公衆衛生上の緊急事態と宣言しました[3]。2023年3月2日現在、110か国以上で合計86,173件の確認症例(そのうち100件で患者が死亡)があります[4、5]。
Mpoxはヒトや他の動物に感染する感染症で、発熱、リンパ節の腫れ、水疱やかさぶたができる発疹などの症状が現れます。最初の感染から症状が出るまでには最長21日かかり、2~4週間続くこともあります。症状が軽度であったり、典型的な症状が全く現れなかったりすることもあり、このため診断が難しく、したがって封じ込めも困難です[6、7]。
この病気は、天然痘ウイルス(天然痘を引き起こすことで知られている)と同じ属であるオルトポックスウイルス属に属する人獣共通DNAウイルスであるMpoxウイルス(MPXV)によって引き起こされます。ヒトに感染するMPXVには2つのタイプがあり、そのうちのクレードII(以前は西アフリカクレードと呼ばれていました)は、中央アフリカ/コンゴ盆地(クレードI)タイプよりも軽度の病気を引き起こします[8]。MPXVは、感染した動物との接触(感染した肉や咬傷や引っかき傷など)によって広がります。ヒトからヒトへの感染は、感染した体液や汚染された物体への曝露、飛沫、およびおそらく空気感染によって起こります。症状が現れてから病変がすべて剥がれるまで(またはそれ以降)まで、人はウイルスを拡散させる可能性があります[8、9]。
したがって、分子診断は、病気の蔓延を制限し、診断を確認するために非常に重要となる可能性があります。1970年代から科学界で知られている病理学であるため、いくつかの論文で分子診断の検証済みのプライマーがすでに提供されています[10]。このアプリケーションノートでは、Mpoxの検出とウイルスタイプの識別のための信頼性が高く迅速な(40〜70分)マルチプレックスアッセイについて説明します。私たちは、現在の流行後もこのようなパネルの使用が一般的になると考えており、この病原体の診断テストを合理化できるようにこのアッセイを設計しました。
Method
PCR Biosystems 社では、文献ですでに入手可能なオリゴヌクレオチド配列に基づいて、マルチプレックスアッセイで MPXV (Generic MPXV) を同時に検出し、クレード I (コンゴ盆地型 MPXV、MPXV_CB) とクレード II (西アフリカ型、MPXV_WA) の両方を同定するためのプロトコルを確立しました。このオリゴヌクレオチド配列は、表 1 にリストされている査読済みジャーナルレポート [10] で特定され、診断の妥当性が検証されたプライマーとプローブの配列を使用しています。このプロトコルでは、新しく開発した Clara® Probe Mix も使用しました。テストテンプレートは、精製された完全な微生物ゲノム (Vircell Amplirun® MBC146-R、西アフリカクレード、スペイン臨床分離株抽出物) または合成 DNA ウイルス配列 (増幅に使用される TFN 受容体配列を含む) のいずれかでした。さまざまな条件でアッセイした後、この病原体の検出用に最適化されたマルチプレックス qPCR プロトコルを紹介します。
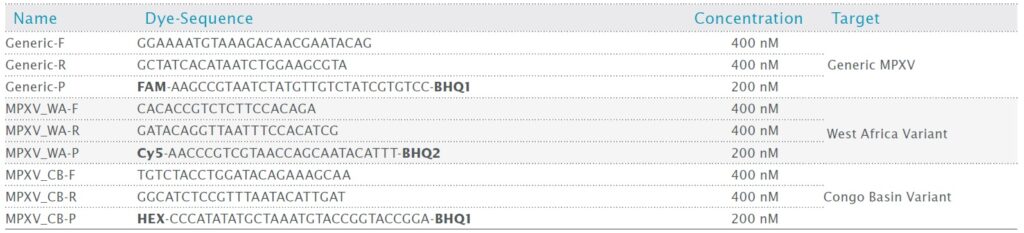
表1:使用したプライマー、プローブおよびターゲット
Primer and template preparation
マルチプレックス反応では、400 μL の 10 μM プライマー (F + R) を 200 μL の 10 μM プローブと混合して、3 つのターゲットのオリゴヌクレオチドを含むプライマー セットを準備しました (これは、0.8 μL の 10 μM プライマー F + R と 0.4 μL の 10 μM プローブを各 20 μL の反応ミックスに加えることに相当します)。
臨床抽出テンプレートは、反応あたり 7,000 コピーから 7 コピーまで、4 ポイント 10 倍希釈系列で準備されました。合成 DNA テンプレートは、反応あたり 5 x 107 から 5 コピーまで、8 ポイント 10 倍希釈系列で準備されました。各ターゲットにはテンプレート コントロール サンプル (NTC) は含まれていませんでした。各サンプルに対して 4 つの技術的複製が実行されました。
Reaction setup
反応は、Qiagen QIAgility ロボットを使用して、最終容量 20 μL で設定され、8.8 μL Milli-Q 水、5 μL 4x Clara® Probe Mix、1.2 μL x プライマー/プローブ ミックス (上記参照)、および 5 μL DNA サンプルが含まれます。表 2 は、追加した成分の最終濃度をまとめたものです。増幅は、Bio-Rad CFX96 Touch qPCR 装置で次のように実行されました。
45 °C 20 分 (逆転写、DNA ターゲットは省略)、95 °C 2 分 (初期変性)、続いて 95 °C 15 秒 (変性) および 60 °C 30 秒 (アニーリング伸長) の 2 ステップ サイクルを 50 回。各サイクルの最後に蛍光測定値を取得しました。
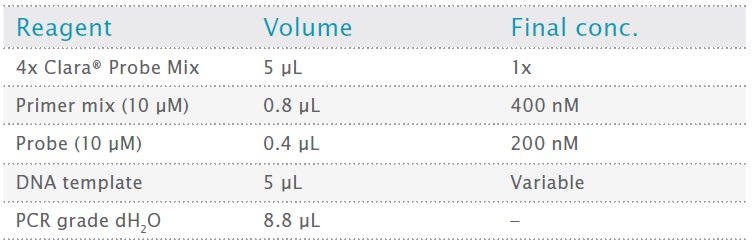
表2:反応のセットアップと構成
Cycling conditions
サーマルサイクリングは、表 3 に示すサイクリング パラメータを使用して、Bio-Rad CFX96 Touch™ qPCR マシン (通常サイクリング用) または BMS MIC qPCR マシン (高速サイクリング用) で実行されました。蛍光測定値は、各サイクルの終了時に取得されました。

表3:サイクリング条件
Results
臨床抽出物では、予想どおり、ジェネリックおよび西アフリカのターゲットのみが 40 サイクル前までに正常に検出されました (図 1)。これは、最低濃度 (20 μL 反応あたり 7 コピー) でも当てはまり、NTC では産物が検出されませんでした。コンゴ盆地 MPXV タイプの系統特異的オリゴヌクレオチドでは、期待どおりの増幅は得られませんでした。2 つのターゲットの効率は 94 ~ 96% で、R2 値はすべてのケースで 99% を超えました。2 つのターゲットの平均 ± SD ターゲット Ct 値は、最高濃度 (反応あたり 7,000 コピー) および最低濃度 (反応あたり 7 コピー) でそれぞれ 26.99 ± 0.03 および 37.21 ± 0.26 (ジェネリック MPXV)、および 28.05 ± 0.05 および 38.02 ± 0.44 (MPXV_WA) でした。
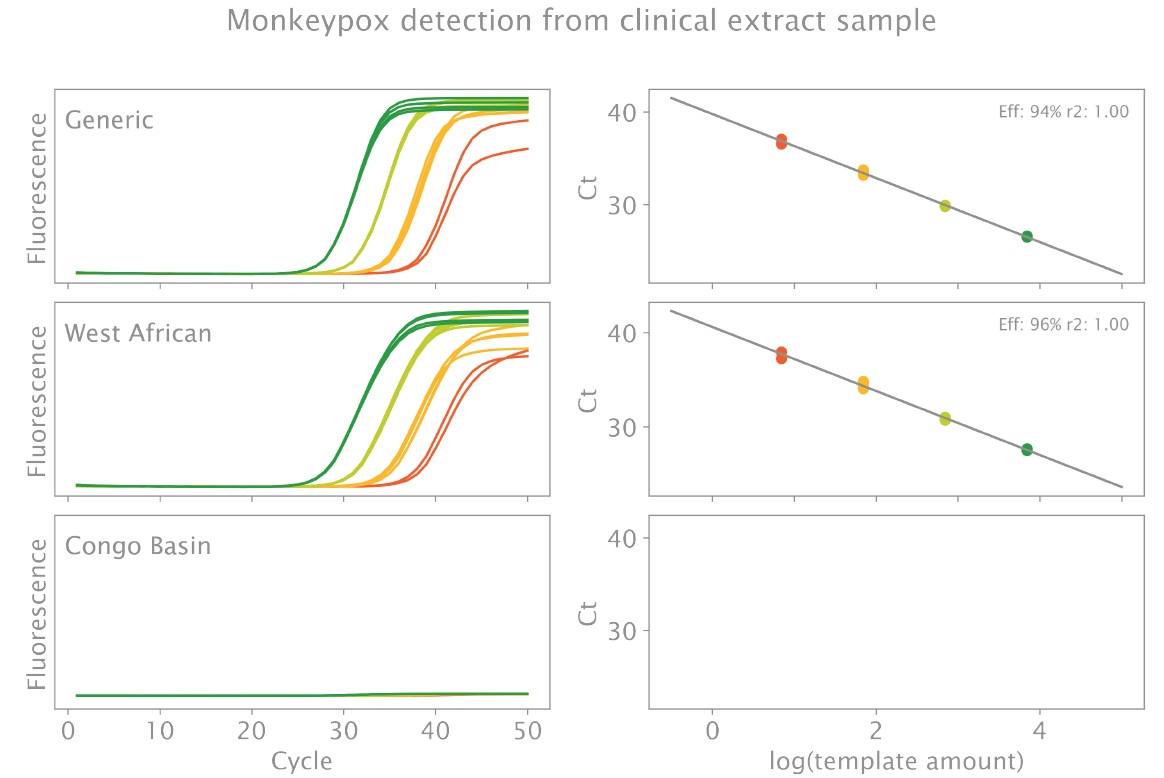
図1:臨床抽出サンプル中の MPXV ターゲットの三重検出 (実験の詳細については本文を参照してください)
一方、合成 DNA ターゲットでは、最低濃度 (20 μL 反応あたり 5 コピー) でも 40 サイクル前に 3 つのターゲットすべてが正常に検出され (図 2)、NTC で生成物は検出されませんでした。3 つのターゲットの効率は 94 ~ 95% で、R2 値はすべてのケースで 99% を超えました。すべてのターゲットの平均 ± SD ターゲット Ct 値は、最高濃度 (反応あたり 50,000,000 コピー) と最低濃度 (反応あたり 5 コピー) でそれぞれ 5.40 ± 0.03 と 29.97 ± 0.21 (Generic MPXV)、7.19 ± 0.07 と 31.81 ± 0.24 (MPXV_CB)、9.51 ± 0.06 と 33.78 ± 0.30 (MPXV_WA) でした。
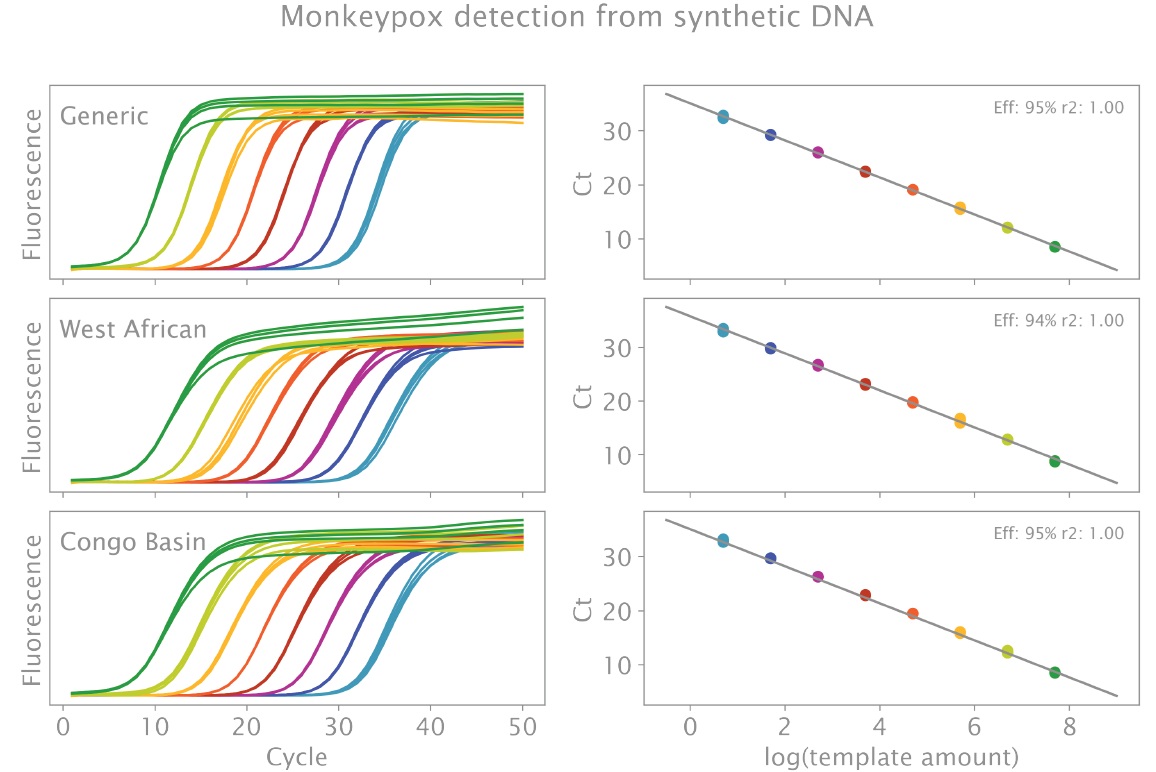
図2:合成 cDNA からの MPXV ターゲットの三重検出 (実験の詳細については本文を参照してください)
通常のサイクリング条件では、MPXV の増幅は約 70 分で達成できます。そのため、図 2 に示す実験を高速サイクリング プログラムで繰り返し、約半分の時間で全体の検出を可能にしました。また、これらの条件下では、最低濃度 (20 μL 反応あたり 5 コピー) でも 40 サイクル前に 3 つのターゲットすべてが正常に検出され (図 3)、NTC で生成物は検出されませんでした。3 つのターゲットの効率は 95 ~ 105% で、すべてのケースで R2 値は 99% を超えました。すべてのターゲットの平均 ± SD ターゲット Ct 値は、最高濃度 (反応あたり 50,000,000 コピー) および最低濃度 (反応あたり 5 コピー) でそれぞれ 8.21 ± 0.09 および 32.07 ± 0.16 (Generic MPXV)、8.07 ± 0.17 および 32.07 ± 0.19 (MPXV_CB)、および 8.68 ± 0.14 および 31.40 ± 0.19 (MPXV_WA) でした。
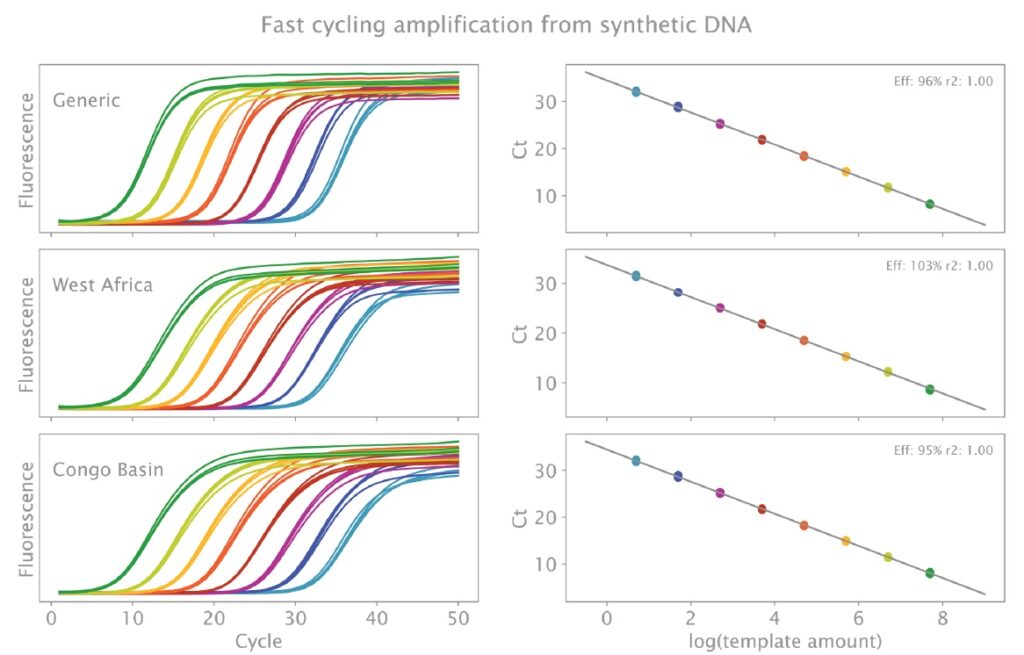
図3:高速サイクリング条件を使用した合成 cDNA からの MPXV ターゲットの三重鎖検出 (実験の詳細については本文を参照してください)
Discussion
ここでは、Mpox 疾患の迅速かつ信頼性の高い検出プロトコルを報告します。私たちのアプローチは、マルチプレックス qPCR 反応で非常に少量のウイルス ターゲット (20 μL 反応あたり 10 コピー未満) を検出することに成功していることが証明されています。BMS MIC qPCR 装置を使用すると、40 分以内に検出できます。これは、1 つの試験管で MPXV を検出し、系統を識別する迅速な手段を提供するため、この病原体の拡散を制限する有効なツールとなります。これらの結果は、マルチプレックス qPCR 反応の威力と効率性も強調しています。この文脈では、同様の病因を持つ病理を確認または除外するために、このパネルに追加のターゲットを含めることができることを述べることが重要です。
本稿執筆時点では、入手可能なワクチンが限られているため、Mpox の蔓延は依然として続いています。そのため、迅速なスクリーニング プログラムは、症状が現れる前であっても症例を特定し隔離するのに役立つ可能性があります。
PCR BioSytems 社の Clara® Probe Mixは、新しいマルチプレックス アッセイの迅速なセットアップを可能にし、さまざまなテンプレート量、サンプル タイプ、ターゲット ヌクレオチド組成で信頼性が高くなるように設計されているため、面倒なマルチプレックス アッセイの最適化が不要になります。
Product use
Clara® Probe Mix を含む PCR Biosystems 社製品は、単独では診断結果を提供できず、研究用途にのみ提供されます。ただし、すべての製品は ISO 13485 準拠の管理システムの下で製造されており、該当する国の法律で許可され、アッセイ自体の臨床検証が済んだ後は、分子診断アッセイのコンポーネントとして使用するのに適しています。
どの製品がお客様のアプリケーションに最適かご相談されたい場合、または MPXV またはその他の DNA 病原体検査に Clara® Probe Mix を使用する方法についてさらに技術的なアドバイスが必要な場合は、弊社までお問い合わせください。
References
- World Health Organisation. Multi-country monkeypox outbreak in non-endemic countries. 21 May 2022; Available from: https://www.who.int/emergencies/disease-outbreak-news/item/2022-DON385.
- UK Health Security Agency. Monkeypox cases confirmed in England – latest updates. 14 May 2022; Available from: https://www.gov.uk/government/news/monkeypox-cases-confirmed-in-england-latest-updates.
- World Health Organisation. WHO Director-General declares the ongoing monkeypox outbreak a Public Health Emergency of International Concern. 23 July 2022; Available from: https://www.who.int/europe/news/item/23-07-2022-who-director-generaldeclares-the-ongoing-monkeypox-outbreak-a-public-health-eventof-international-concern.
- Max Kozlov, Monkeypox declared a global emergency: will it help contain the outbreak? Nature, 25 July 2022. Available from: https://www.nature.com/articles/d41586-022-02054-7.
- Multi-country outbreak of mpox, External Situation report #7 -2 March 2023; Available from: https://www.who.int/publications/m/item/multi-country-outbreak-of-mpox–external-situation-report—17—2-march-2023
- World Health Organisation. Monkeypox. 19 May 2022; Available from:https://www.who.int/news-room/fact-sheets/detai l/monkeypox.
- Centers for Disease Control and Prevention. Signs and Symptoms of Monkeypox disease. 18 October 2022; Available from: https://www.cdc.gov/poxvirus/monkeypox/symptoms/index.html.
- Hugh Adler, et al., Clinical features and management of human monkeypox: a retrospective observational study in the UK. Lancet Infect Dis, 2022. 22(8): p. 1153-1162.
- Catherine G. Sutcliffe, Anne W. Rimoin, and William J. Moss, Poxviruses, in Ryan, Hill, Solomon, Aronson, and Endy (editors). Hunter’s Tropical Medicine and Emerging Infectious Diseases Elsevier: Edinburgh, 2020. p. 272-278.
- Yu Li, et al., Real-time PCR assays for the specific detection of monkeypox virus West African and Congo Basin strain DNA. J Virol Methods, 2010. 169(1): p. 223-227.
